Inhalte
Was sind Onkogene?
Ein Onkogen ist ein zelluläres Gen, dessen Expression wahrscheinlich die Entwicklung von Krebs fördert. Welche Arten von Onkogenen gibt es? Durch welche Mechanismen werden sie aktiviert? Erläuterungen.
Was ist ein Onkogen?
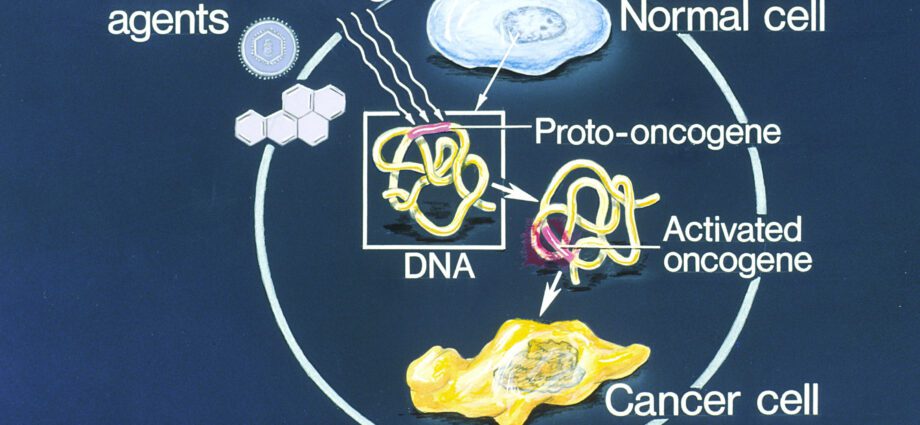
Ein Onkogen (von griechisch onkos, Tumor und Genos, Geburt), auch Proto-Onkogen (c-onc) genannt, ist ein Gen, dessen Expression wahrscheinlich einer normalen eukaryotischen Zelle einen kanzerösen Phänotyp verleiht. In der Tat kontrollieren Onkogene die Synthese von Proteinen, die die Zellteilung stimulieren (sogenannte Onkoproteine) oder den programmierten Zelltod (oder Apoptose) hemmen. Onkogene sind für die unkontrollierte Zellproliferation verantwortlich, die für die Entwicklung von Krebszellen prädisponiert.
Onkogene werden in 6 Klassen eingeteilt, die jeweils den Onkoproteinen entsprechen, für die sie kodieren:
- Wachstumsfaktoren. Beispiel: das Proto-Onkogen kodierende Proteine der FGF-Familie (Fibroblast Growth Factor);
- Transmembran-Wachstumsfaktor-Rezeptoren. Beispiel: das Proto-Onkogen erb B, das für den EGF (Epidermal Growth Factor)-Rezeptor kodiert;
- G-Proteine oder Membranproteine, die GTP binden. Beispiel: Proto-Onkogene der ras-Familie;
- Membran-Tyrosin-Proteinkinasen;
- Membranproteinkinasen;
- Proteine mit Kernaktivität.Beispiel: Proto-Onkogene Erb A, phos, Juni et c-myc.
Welche Rolle spielen Onkogene?
Die Zellerneuerung wird durch die Zellzyklus. Letztere wird durch eine Reihe von Ereignissen definiert, die aus einer Mutterzelle zwei Tochterzellen erzeugen. Es handelt sich dabei um Zellteilung oder „Mitose“.
Der Zellzyklus muss reguliert werden. Wenn die Zellteilung nicht ausreicht, funktioniert der Organismus nicht optimal; Umgekehrt vermehren sich Zellen bei reichlicher Zellteilung unkontrolliert, was das Auftreten von Krebszellen fördert.
Die Regulation des Zellzyklus wird durch Gene gewährleistet, die in zwei Kategorien eingeteilt werden:
- Anti-Onkogene, die die Zellproliferation durch Verlangsamung des Zellzyklus hemmen;
- Proto-Onkogene (c-onc) oder Onkogene, die die Zellproliferation durch Aktivierung des Zellzyklus fördern.
Vergleichen wir den Zellzyklus mit einem Auto, wären die Anti-Onkogene die Bremsen und die Proto-Onkogene die Beschleuniger des letzteren.
Anomalien, Pathologien im Zusammenhang mit Onkogenen
Die Erscheinung eines Tumors kann aus einer Mutation resultieren, die Anti-Onkogene inaktiviert, oder im Gegenteil aus einer Mutation, die Proto-Onkogene (oder Onkogene) aktiviert.
Ein Funktionsverlust von Anti-Onkogenen hindert sie daran, ihre zellproliferationshemmende Wirkung auszuüben. Die Hemmung von Anti-Onkogenen ist die Tür zu einer unkontrollierten Zellteilung, die zum Auftreten bösartiger Zellen führen kann.
Anti-Onkogene sind jedoch zelluläre Gene, das heißt, sie liegen doppelt auf dem Chromosomenpaar vor, das sie im Zellkern trägt. Wenn also eine Kopie des Anti-Onkogens nicht funktionsfähig ist, ermöglicht die andere, als Bremse zu wirken, so dass das Subjekt gegen Zellproliferation und gegen das Risiko von Tumoren geschützt ist. Dies ist beispielsweise beim BRCA1-Gen der Fall, dessen hemmende Mutation Brustkrebs aufdeckt. Ist jedoch die zweite Kopie dieses Gens funktionsfähig, bleibt der Patient geschützt, obwohl er aufgrund der defekten ersten Kopie prädisponiert ist. Als Teil einer solchen Veranlagung wird manchmal eine präventive Doppelmastektomie in Betracht gezogen.
Umgekehrt verstärkt die aktivierende Mutation, die Proto-Onkogene betrifft, ihre stimulierende Wirkung auf die Zellproliferation. Diese anarchische Zellproliferation prädisponiert für die Entwicklung von Krebs.
Genau wie Anti-Onkogene sind Pro-Onkogene zelluläre Gene, die doppelt auf dem Chromosomenpaar vorhanden sind, das sie trägt. Im Gegensatz zu Anti-Onkongenen reicht jedoch die Anwesenheit eines einzigen mutierten Pro-Onkogens aus, um die befürchteten Wirkungen (in diesem Fall die Zellproliferation) zu erzeugen. Der Patient, der diese Mutation trägt, ist daher krebsgefährdet.
Mutationen in Onkogenen können spontan, erblich oder sogar durch Mutagene (Chemikalien, UV-Strahlen etc.) verursacht sein.
Aktivierung von Onkogenen: die beteiligten Mechanismen
Der Aktivierung von Mutationen von Onkogenen oder Pro-Onkogenen (c-onc) liegen mehrere Mechanismen zugrunde:
- virale Integration: Insertion des DNA-Virus auf der Ebene eines regulatorischen Gens. Dies ist beispielsweise beim humanen Papillomavirus (HPV) der Fall, das sexuell übertragen wird;
- Punktmutation in einer Sequenz eines Gens, das ein Protein codiert;
- Deletion: Verlust eines größeren oder kleineren DNA-Fragments, das eine Ursache für eine genetische Mutation darstellt;
- strukturelle Neuordnung: Chromosomenveränderung (Translokation, Inversion), die zur Bildung eines Hybridgens führt, das für ein nicht-funktionelles Protein kodiert;
- Amplifikation: anormale Vermehrung der Kopienzahl des Gens in der Zelle. Diese Amplifikation führt im Allgemeinen zu einer Erhöhung des Expressionsniveaus eines Gens;
- die Deregulierung der Expression einer RNA: Die Gene werden von ihrer normalen molekularen Umgebung getrennt und unter die unangemessene Kontrolle anderer Sequenzen gestellt, wodurch ihre Expression verändert wird.
Beispiele für Onkogene
Gene, die Wachstumsfaktoren oder deren Rezeptoren kodieren:
- PDGF: kodiert den Blutplättchen-Wachstumsfaktor, der mit Gliom (einem Gehirnkrebs) verbunden ist;Erb-B: kodiert den epidermalen Wachstumsfaktorrezeptor. Im Zusammenhang mit Glioblastom (einem Krebs des Gehirns) und Brustkrebs;
- Erb-B2, auch HER-2 oder neu genannt: kodiert für einen Wachstumsfaktor-Rezeptor. Verbunden mit Brust-, Speicheldrüsen- und Eierstockkrebs;
- RET: kodiert für einen Wachstumsfaktorrezeptor. Verbunden mit Schilddrüsenkrebs.
Gene, die zytoplasmatische Relais in den Stimulationswegen kodieren:
- Ki-ras: assoziiert mit Lungen-, Eierstock-, Dickdarm- und Bauchspeicheldrüsenkrebs;
- N-ras: assoziiert mit Leukämie.
Gene, die Transkriptionsfaktoren kodieren, die wachstumsfördernde Gene aktivieren:
- C-myc: assoziiert mit Leukämie und Brust-, Magen- und Lungenkrebs;
- N-myc: assoziiert mit Neuroblastom (ein Krebs von Nervenzellen) und Glioblastom;
- L-myc: assoziiert mit Lungenkrebs.
Gene, die andere Moleküle kodieren:
- Hcl-2: kodiert für ein Protein, das normalerweise den Selbstmord von Zellen blockiert. Verbunden mit Lymphomen von B-Lymphozyten;
- Bel-1: auch PRAD1 genannt. Kodiert Cyclin DXNUMX, einen Aktivator für den Zellzyklus. Im Zusammenhang mit Brust-, Kopf- und Halskrebs;
- MDM2: kodiert für einen Antagonisten des vom Tumorsuppressorgen produzierten Proteins.
- P53: assoziiert mit Sarkomen (Krebs des Bindegewebes) und anderen Krebsarten.
Fokus auf Ocongen-Viren
Onkogene Viren sind Viren, die die Zelle, die sie infizieren, zu Krebs machen können. 15 % der Krebserkrankungen haben eine virale Ätiologie und diese viralen Krebsarten sind die Ursache für etwa 1.5 Millionen neue Fälle pro Jahr und 900 Todesfälle pro Jahr weltweit.
Assoziierte virale Krebserkrankungen sind ein Problem der öffentlichen Gesundheit:
- das Papillomavirus wird mit fast 90 % der Gebärmutterhalskrebserkrankungen in Verbindung gebracht;
- 75% aller Hepatokarzinome sind mit dem Hepatitis-B- und -C-Virus verbunden.
Es gibt fünf Kategorien onkogener Viren, unabhängig davon, ob es sich um RNA-Viren oder DNA-Viren handelt.
RNA-Viren
- Retroviridae (HTVL-1) birgt das Risiko einer T-Leukämie;
- Flaviviridae (Hepatitis-C-Virus) ist gefährdet für ein hepatozelluläres Karzinom.
DNA-Viren
- Papovaviridae (Papillomavirus 16 und 18) ist Gebärmutterhalskrebs ausgesetzt;
- Herpesviridae (Esptein-Barr-Virus) exponiert B-Lymphom und -Karzinom;
- Herpesviridae (humanes Herpesvirus 8) ist der Kaposi-Krankheit und Lymphomen ausgesetzt;
- Hepadnaviridae (Hepatitis-B-Virus) ist anfällig für hepatozelluläres Karzinom.