Inhalte
Creutzfeldt-Jakob-Krankheit
Was ist es ?
Die Creutzfeldt-Jakob-Krankheit gehört zu den Prionenkrankheiten. Dies sind seltene Erkrankungen, die durch eine Degeneration des zentralen Nervensystems gekennzeichnet sind und auch als subakute übertragbare spongiforme Enzephalopathien (TSE) bezeichnet werden. Sie werden durch die Ansammlung eines normalen, aber schlecht angepassten Proteins im Gehirn verursacht, dem Prionenprotein (1). Leider ist die Creutzfeldt-Jakob-Krankheit durch einen schnellen und tödlichen Verlauf sowie durch das Ausbleiben einer Behandlung gekennzeichnet. In Frankreich gibt es jedes Jahr 100 bis 150 Fälle (2).
Symptome
Die Krankheit beginnt oft mit unspezifischen Störungen wie Schlaflosigkeit oder Angstzuständen. Allmählich stellen sich Gedächtnis-, Orientierungs- und Sprachstörungen ein. Sie äußern sich dann in psychiatrischen Störungen sowie einer zerebellären Ataxie (Instabilität beim bewegungslosen Stehen und beim Gehen, die von einem Taumeln ähnlich dem einer Trunkenheit begleitet wird). Auch im Zentralnervensystem gibt es typische Läsionen (floride Plaques, amyloide Ablagerungen von PrPres, umgeben von Vakuolen).
Betroffen sind beide Geschlechter, allerdings mit hoher Häufigkeit bei jungen Erwachsenen.
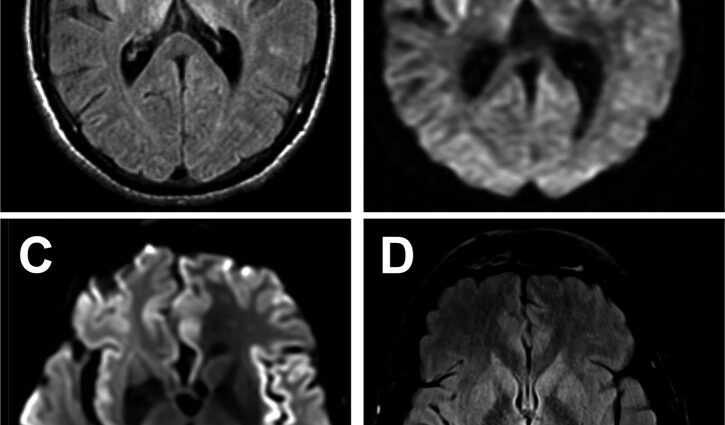
Leider gibt es keinen zuverlässigen Diagnosetest. Ein Elektroenzephalogramm (EEG) kann relativ spezifische Störungen der Gehirnaktivität erkennen. Die MRT zeigt spezifische Auffälligkeiten in bestimmten Hirnregionen (Basalganglien, Kortex), für die es nur wenige Differenzialdiagnosen gibt.
Wenn all diese klinischen und paraklinischen Elemente die Diagnose der Creutzfeldt-Jakob-Krankheit ermöglichen, ist dies nur eine wahrscheinliche Diagnose: Tatsächlich ermöglicht nur die Untersuchung des Hirngewebes, die nach dem Tod häufiger durchgeführt wird, die Bestätigung der Diagnose.
Die Ursprünge der Krankheit
Die Creutzfeld-Jakob-Krankheit ist die einzige Erkrankung des Menschen, die genetisch bedingt sein kann (aufgrund einer Mutation im Gen, das das Prionprotein kodiert, wobei die E200K-Mutation die häufigste ist), infektiöse Ursache (sekundär nach Kontamination) oder sporadisch (von zufälliges Auftreten, ohne Mutation oder Exposition gegenüber einem gefundenen exogenen Prion).
Die sporadische Form ist jedoch die häufigste: Sie macht 85 % aller jährlich diagnostizierten subakuten übertragbaren spongiformen Enzephalopathien (TSE) aus. In diesem Fall tritt die Krankheit in der Regel nach 60 Jahren auf und schreitet über einen Zeitraum von etwa 6 Monaten fort. Wenn die Krankheit genetisch oder infektiös ist, treten die Symptome früher auf und schreiten langsamer voran. Bei infektiösen Formen kann die Inkubationszeit extrem lang sein und 50 Jahre überschreiten.
Risikofaktoren
Das Prionprotein (PrPc) ist ein physiologisches Protein, das in vielen Arten sehr konserviert vorkommt. In Neuronen des Gehirns kann das Prion-Protein pathogen werden, indem es seine dreidimensionale Konformation verändert: Es faltet sich sehr eng zusammen, was es hydrophob, schwerlöslich und resistent gegen Abbau macht. Es wird dann als „Scrapie“-Prionprotein (PrPsc) bezeichnet. PrPSc aggregieren miteinander und bilden Ablagerungen, die sich innerhalb und außerhalb von Gehirnzellen vermehren und deren Funktion und Überlebensmechanismen stören.
In dieser abnormen Form ist das Prion-Protein auch in der Lage, seine Konformationsanomalie zu übertragen: Bei Kontakt mit einem PrPsc nimmt ein normales Prion-Protein wiederum eine abnorme Konformation an. Dies ist der Dominoeffekt.
Das Risiko der Übertragung zwischen Einzelpersonen
Bei einer Gewebetransplantation oder nach Gabe von Wachstumshormonen ist eine interindividuelle Übertragung von Prionenerkrankungen möglich. Die riskantesten Gewebe stammen aus dem Zentralnervensystem und dem Auge. In geringerem Maße können auch Gehirn-Rückenmarks-Flüssigkeit, Blut und bestimmte Organe (Nieren, Lunge usw.) das abnormale Prion übertragen.
Das Lebensmittelrisiko
Die Übertragung eines Prions vom Rind auf den Menschen durch den Verzehr kontaminierter Lebensmittel wurde 1996 während der dramatischen „Rinderwahnsinnskrise“ vermutet. Seit mehreren Jahren befällt eine Epidemie der bovinen spongiformen Enzephalopathie (BSE) Herden im Vereinigten Königreich3. Die Verbreitung dieser Prionenkrankheit, von der jedes Jahr Zehntausende Tiere befallen, ist zweifellos auf die Verwendung von Tiermehl zurückzuführen, das aus Kadavern gewonnen und unzureichend dekontaminiert wurde. Sein Ursprung bleibt jedoch umstritten.
Prävention und Behandlung
Heute gibt es keine spezifische Behandlung für Prionenkrankheiten. Die einzigen Medikamente, die verschrieben werden können, sind solche, die die verschiedenen Symptome der Krankheit lindern oder einschränken können. Medizinische, soziale und psychologische Unterstützung wird Patienten und ihren Familien von der National CJD Support Unit angeboten. Die Suche nach Medikamenten, die die Umwandlung von PrPc verhindern, die Eliminierung abnormaler Formen des Proteins fördern und seine Verbreitung begrenzen sollen, ist hoffnungsvoll. Eine interessante Leitstruktur zielt auf PDK1, einen der zellulären Mediatoren, die während der Infektion beteiligt sind. Seine Hemmung würde es ermöglichen, sowohl das Umwandlungsphänomen durch Förderung der Spaltung von PrPc zu hemmen, als auch die Folgen seiner Replikation auf das Überleben von Neuronen abzuschwächen.